Paper Ikatan Kimia
IKATAN
KIMIA
Suatu atom bergabung dengan atom lainnya melalui
ikatan kimia sehingga dapat membentuk senyawa, baik senyawa kovalen maupun
senyawa ion. Senyawa ion terbentuk melalui ikatan ion, yaitu ikatan yang
terjadi antara ion positif (atom yang melepaskan elektron) dan ion negatif
(atom yang menangkap elektron). Akibatnya, senyawa ion yang terbentuk bersifat
polar.
Ikatan kimia adalah gaya tarik menarik yang kuat antara atom-atom
tertentu di dalam suatu zat. Perubahan kimia atau reaksi kimia terjadi karena
penggabungan atau pemisahan atom-atom dengan cara tertentu sehingga terbentuk
zat yang lebih stabil.
Hasil reaksi kimia
dapat mempunyai bentuk molekul tertentu atau dapat pula menghasilkan kristal
dengan bentuk tertentu yang akan menentukan sifat-sifat zat hasil tersebut.
Tidak semua jenis
atom dapat bergabung dengan jenis atom lain membentuk senyawa.
beberapa macam ikatan kimia yaitu:
1. Ikatan ion /
ikatan elektrovalen / ikatan heteropolar
2. Ikatan
kovalen / ikatan atom / ikatan homopolar
3. Ikatan
kovalen koordinasi / ikatan semipolar
4. Ikatan logam
5. Ikatan
Hidrogen
6. Ikatan
(Gaya) Van Der Waals.
Ikatan kimia tidak hanya terjadi dengan
cara membentukan persekutuan pasangan elektron antara antom-atom yang bergabung
seperti halnya dengan ikatan kovalen,melainkan dapat juga terjadi dengan cara
pemindahan elektron yang menghasilkan ion positif (kation) dan ion negatif
(anion).Gaya tarik elektrostatik antara kedua ion yang berbeda muatan inilah
yang memelihara kestabilan ikatan dalam spesies yang terjadi.Ikatan demikian
ini di katakan sebagai ikatan iodik,namun kenyataannya hanya sedikit senyawa yang
bersifat ionik murni.
Satu
percobaan yang paling sederhana adalah pemasangan alat uji antaran jenis
(konduktivitas) di dalam air murni.Hasil amatan menunjukkan bahwa bola lampu
tidak menyala,yang berarti air tidak menghantarkan listrik.Tetapi,jika ke dalam
air dilarutkan garam NaCl ternyata bola
lampu menyala.Pada tahun 1884, Svante Arrhenius mengajukan teori disosiasi
elektrolit untuk menjelaskan hail percobaan tersebut,dan pada waktu itu hampir
tidak ada seseorong menerima usalan teori tersebut.Lebih sayang lagi,thesis
dokternya perihal kesimpulan tersebut memperoleh nilai rendah.Namun
demikian,mulai tahun 1891 terdapat banyak dukungan terhadap usulan bahwa
partikel-partikel dalam larutan mengalami ionisasi menjadi ion-ion.akhirnya
pada tahun 1903 signifikan hasil kerjanya disadari oleh banyak ahli,Arrhenius
diusulkan untuk mendapatkan hadiah nobel dalam dalam bidang kimia dan fisika;
namun,karena para fisikawan menolaknya,ia menerima hadiah nobel tersebut hanya
dalam bidang kimia.Pada waktu itu,masyarakat ilmuwan (saintis) menjelasan bahwa garam dapur terpecah menjadi
ion-ion natrium dan ion klorida dalam larutan tetapi ion-ion tidak sama dengan
atom-atom natrium dan atom-atom klorida.Tak diragukan lagi bahwa ide tersebut
ditolak hingga abat penemuan elektron (tahun1895) oleh J.J Thomson ( yang
mendapatkan hadiah nobel pada tahun 1906).
Antara dua atom atau lebih dapat saling berinteraksi
dan membentuk molekul. Interaksi ini selalu disertai dengan pelepasan energi.
Adapun gaya-gaya yang menahan atom-atom dalam molekul merupakan suatu ikatan
yang dinamakan ikatan kimia. Ikatan kimia terbentuk karena unsure-unsur
cenderung membentuk struktur elektron stabil. Struktur elektron stabil yaitu
struktur elektron gas mulia ( Golongan VIII A ) Seperti dalam tabel berikut :
Unsur
|
No Atom
|
K
|
L
|
N
|
M
|
O
|
P
|
He
Ne
Ar
Kr
Xe
Rn
|
2
10
18
36
54
86
|
2
2
2
2
2
2
|
8
8
8
8
8
|
8
18
18
18
|
8
18
32
|
8
18
|
8
|
Unsur
|
Susunan elektron
|
Elektron valensi
|
6C
8O
12Mg
13Al
15P
17Cl
|
2. 4
2.6
2.8.2
2.8.3
2.8.5
2.8.7
|
4
6
2
3
5
7
|
2. Molekul triangular (sudut segitiga) yang rata (dalam satu bidang)
3. Molekul tetrahedron
4. Molekul bipiramida trigonal
5. Molekul oktahedron
- Mempunyai konduktivitas termal dan listrik yang tinggi.
- Berkilau dan memantulkan cahaya.
- Dapat ditempa.
- Mempunyai variasi kekuatan mekanik.
· Model Lautan Elektron
1. Energi ionisasi yang rendah
2. Banyak orbital kosong
· Contoh Ikatan Logam
o Sifat Kekuatan Ikatan Hidrogen
o Pembentukan Ikatan Hidrogen
Apabila atom hidrogen terikat pada atom lain, terutama F, O, N, atau Cl, sedemikian sehingga ikatan X-H bersifat sangat polar dengan daerah positif pada atom H, maka atom H ini dapat berinteraksi dengan spesies negatif lain atau spesies kaya elektron membentuk ikatan hidrogen (Xδ- - Hδ+•••Y ; H•••Y = ikatan hidrogen). Walaupun detilnya sangat bervariasi, tetapi umumnya dipercaya bahwa sifat khas gaya elektrostatik yang besar antara atom H dan Y. Konsekuensinya, jarak ikatan X-H dengan ikatan hidrogen akan menjadi lebih panjang, sekalipun tetap sebagai ikatan kovalen tunggal, daripada panjang ikatan normal X-H tanpa ikatan hidrogen. Demikian juga jarak H•••Y umumnya lebih panjang daripada jarak ikatan normal H-Y. Dalam hal ikatan hidrogen sangat kuat, jarak X•••Y menjadi sangat pendek dan panjang ikatan antara X-H dan H•••Y keduanya menjadi pendek dan hampir sama
Walter Kossel dan Gilbert Lewis pada tahun 1916
menyatakan bahwa terdapat hubungan antara stabilnya gas mulia dengan cara atom
berikatan. Mereka mengemukakan bahwa jumlah elektron terluar dari dua atom yang
berikatan, akan berubah sedemikian rupa sehingga susunan kedua elektron kedua
atom tersebut sama dengan susunan gas mulia. Kecenderungan atom-atom untuk memiliki
struktur atau konfigurasi elektron gas mulia atau 8 elektron pada kulit terluar
disebut kaidah oktet
Sementara itu,atom-atom yang mempunyai nomor atom
kecil dari hydrogen sampai dengan boron cenderung memiliki konvegurasi elektron
gas helium atau mengikuti kaidah Duplet.
Unsur – unsur dari golongan alkali dan alkali tanah ,
untuk menyapai kestabilan cenderung melepaskan elektron terluarnya sehingga
membentuk ion positif . unsnr – unsnr yang mempunyai kecendrungan membentuk ion
positif termasuk unsur elektro positif . unsnr – unsur dari golongan halogen
dan khalkhogen mempunyai kecendrungan menangkap elektron untuk
mencapai kestabilan sehingga membentuk ion negative. Unsur - unsur
yang demikian termasuk unsur elektronnegatif.
Ikatan kimia merupakan sebuah proses fisika yang
bertanggungung jawab dalam gaya interaksi tarik menarik antara dua
atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik
menjadi stabil.
Ikatan
kimia secara umum dibagi menjadi dua kategori utama, yaitu ikatan ion dan ikatan kovalen. Ikatan ion muncul sebagai
gaya tarik – menarik murni antara partikel bermuatan berlawanan sehingga ikatan
ion non direksional. Artinya pembentukan ion dalam kluster ditentukan dengan
mudah oleh keseimbangan yang terjadi antara gaya tarik dan gaya tolak antara
ion – ion , tidak disebabkan oleh struktur elektronnya. Ikatan kovalen
sebaliknya, mempunyai sifat direksional yang sangat kuat. Zat – zat ikatan
kovalen, misalnya molekul atau poliatom, mempunyai bentuk tertentu yang
biasanya tetap terbentuknya apabila zat tersebut mengalami perubahan fisika
seperti mencair atau menguap.
Bentuk molekul, yang berarti cara atom
tersusun di dalam ruang mempengaruhi banyak sifat- sifat fisika dan kimia
molekul tersebut. Bentuk molekul dapat ditentukan tanpa memperhatikan apakah
molekul tersebut polar atau tidak. Polaritas molekul mempunyai pengaruh yang
kuat pada sifat fisika seperti titik leleh dan titik didih. Bentuk molekul
dapat juga mempengaruhi sifat kimia.
1. Ikatan
antar atom
v
Ikatan ion
1. Pengertian Ikatan Ion
Ikatan ion adalah ikatan yang terbentuk sebagai akibat adanya gaya tarik-menarik antara ion positif dan ion negatif. Ion positif terbentuk karena unsur logam melepaskan elektronnya, sedangkan ion negatif terbentuk karena unsur nonlogam menerima elektron. Ikatan ion terjadi karena adanya serah terima elektron. [1]
Atom-atom membentuk ikatan ion karena masing-masing atom ingin mencapai keseimbangan/kestabilan seperti struktur elektron gas mulia. Ikatan ion terbentuk antara:
a. ion positif dengan ion negatif,
b. atom-atom berenergi potensial ionisasi kecil dengan atom-atom berafinitas elektron besar (Atom-atom unsur golongan IA, IIA dengan atom-atom unsur golongan VIA, VIIA),
c. atom-atom dengan keelektronegatifan kecil dengan atom-atom yang mempunyai keelektronegatifan besar. [1]
Sifat-sifat senyawa ion sebagai berikut.
a. Dalam bentuk padatan tidak menghantar listrik karena partikel-partikel ionnya terikat kuat pada kisi, sehingga tidak ada elektron yang bebas bergerak.
b. Leburan dan larutannya menghantarkan listrik.
c. Umumnya berupa zat padat kristal yang permukaannya keras dan sukar digores.
d. Titik leleh dan titik didihnya tinggi.
e. Larut dalam pelarut polar dan tidak larut dalam pelarut nonpolar. [1]
2. Atom Na dan Cl Berikatan dengan Cara Serah Terima Elektron
Atom Na memiliki konfigurasi elektron 2 8 1 sehingga elektron valensinya
1. Adapun konfigurasi elektron atom Cl adalah 2 8 7 sehingga elektron
valensinya adalah 7. Dalam keadaan netral, atom Na dan Cl memiliki
jumlah elektron dan proton yang sama banyak. Atom Na memiliki 11 proton
dan 11 elektron, sedangkan atom Cl memiliki 17 proton dan 17 elektron.
Pada keadaan ini, atom Na dan Cl tidak stabil. Berdasarkan kaidah oktet,
untuk mencapai kestabilannya, atom Na harus melepaskan 1 elektron,
sedangkan atom Cl membutuhkan 1 elektron. Apakah yang terjadi jika atom
Na melepaskan elektron dan atom Cl menerima 1 elektron?
Atom Na akan bermuatan positif karena jumlah proton lebih banyak
daripada jumlah elektron. Adapun atom Cl akan bermuatan negatif karena
jumlah proton lebih sedikit daripada jumlah elektron. Dengan demikian,
atom Na dan Cl dapat mencapai kestabilannya dengan cara serah terima
elektron. Atom Na menyerahkan 1 elektron kepada atom Cl sehingga atom Cl
menerima 1 elektron dari atom Na.
Karena berbeda muatan, ion Na+ dan ion Cl– akan
saling tarik-menarik. Interaksi yang dinamakan interaksi elektrostatik
ini berlangsung secara terusmenerus. Ikatan kimia yang terbentuk dengan
cara serah terima elektron, seperti pembentukan NaCl, dinamakan ikatan
ion. Senyawa yang terbentuk melalui ikatan ion disebut senyawa ion.
Catatan Kimia :
Ikatan ion adalah ikatan elektrostatik antara kation dan anion yang
menyatukan ion-ion menjadi senyawa ionik. Contohnya ikatan pada senyawa
NaCl.
Menurut Anda, adakah senyawa lain selain NaCl yang proses pembentukan
senyawanya melalui ikatan ion? Pelajarilah contoh soal berikut.
Contoh Soal 1 :
Bagaimana proses pembentukan ikatan ion pada senyawa-senyawa berikut.
a. CaCl2
b. MgO
Kunci Jawaban :
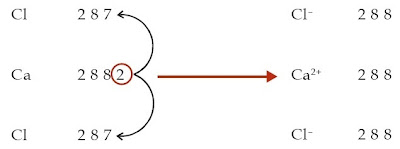
a. Konfigurasi elektron atom Ca: 2 8 8 2
Konfigurasi elektron atom Cl: 2 8 7
Untuk mencapai kestabilannya, atom Ca harus melepaskan 2 elektron,
sedangkan atom Cl membutuhkan 1 elektron. Jadi, atom Ca memberikan
masing-masing 1 elektron kepada 2 atom Cl sehingga 1 atom Ca mengikat 2
atom Cl. Setelah melepaskan 2 elektron, atom Ca menjadi ion Ca2+. Adapun atom Cl menjadi ion Cl– setelah menerima 1 elektron. Senyawa yang terbentuk adalah CaCl2.
b. Konfigurasi atom Mg: 2 8 2
Konfigurasi atom O: 2 6
Untuk mencapai kestabilannya, atom Mg harus melepaskan 2 elektron,
sedangkan atom O membutuhkan 2 elektron. Jadi, atom Mg memberikan 2
elektron kepada atom O sehingga 1 atom Mg mengikat 1 atom O. Setelah
melepaskan 1 elektron, atom Mg menjadi ion Mg2+ . Adapun atom O menjadi ion O2–, senyawa yang terbentuk adalah MgO.
Contoh Soal 2 :
Unsur Mg, C, N, O dan S berturut-turut memiliki nomor atom: 12, 6, 7, 8,
dan 16. Pasangan unsur yang memiliki ikatan ionik adalah ....
A. C dan S
B. Mg dan O
C. N dan O
D. C dan O
E. C dan N
Kunci Jawaban :
Ikatan ionik adalah ikatan antara unsur logam dan non logam. Ikatan ion
terjadi antara unsur yang melepas elektron dan unsur yang menerima
elektron. Unsur logam: Mg Unsur non logam: C, N, O, S Jadi, yang mungkin
terjadi ikatan ion adalah (B) Mg dan O.
3. Senyawa Ion Memiliki Struktur Ion Raksasa (Lattice)
Garam dapur (NaCl) merupakan senyawa ionik yang penting dalam kehidupan
sehari-hari. Petani garam memperoleh kristal NaCl secara tradisional
yaitu dengan cara menguapkan air laut dengan bantuan sinar matahari.
Jutaan atau bahkan miliaran ion Na+ dan ion Cl- dalam
garam saling tarik-menarik sehingga membentuk struktur ion raksasa.
Bagian kecil dari struktur ion raksasa NaCl dapat diamati pada gambar
berikut.
Jika Anda mengamati gambar tersebut secara teliti, Anda akan melihat bahwa setiap ion Na+ dapat mengikat 6 ion Cl-. Begitu pula dengan ion Cl- yang dapat mengikat 6 ion Na+.
Contoh Soal 3 :
Nomor atom unsur A, B, C, D, dan E berturut-turut 6, 8, 9, 16, dan 19.
Pasangan unsur yang dapat membentuk ikatan ion adalah pasangan antara
unsur ….
A. A dan C
B. C dan E
C. B dan D
D. C dan D
E. A dan B
Kunci Jawaban :
Ikatan ion terbentuk antara atom logam dan nonlogam. Sifat atom logam dan nonlogam ditentukan oleh elektron valensi.
Atom
|
Nomor
Atom
|
Konfigurasi
Elektron
|
Elektron
Valensi
|
Sifat
Atom
|
A
|
6
|
2
4
|
4
|
Nonlogam
|
B
|
8
|
2
6
|
6
|
Nonlogam
|
C
|
9
|
2
7
|
7
|
Nonlogam
|
D
|
16
|
2
8 6
|
6
|
Nonlogam
|
E
|
19
|
2
8 8 1
|
1
|
Logam
|
Jadi, pasangan yang dapat membentuk ikatan ion adalah (B) C dan E.
3. NaCl Memiliki Titik Didih yang Sangat Tinggi dan Mudah Rapuh
Na+ dan Cl- memiliki
interaksi elektrostatik yang sangat kuat sehingga untuk memutuskan
ikatan tersebut diperlukan energi yang cukup tinggi. Itulah sebabnya
senyawa NaCl memiliki titik didih yang sangat tinggi, yaitu 1.465 °C.
Selain titik didih yang sangat tinggi, NaCl juga memiliki sifat mudah
rapuh. Mengapa demikian? Struktur NaCl tersusun atas beberapa lapisan.
Bayangkanlah apa yang akan terjadi jika lapisan bagian atas kristal NaCl
diberikan dorongan.
Lapisan bagian atas akan bergeser sehingga ion-ion pada lapisan atas dan
lapisan di bawahnya yang bermuatan sama akan saling berhadapan. Anda
tentu telah mengetahui bahwa ion-ion yang bermuatan sama akan
tolak-menolak. Dengan demikian, ikatan akan terlepas sehingga tidak
heran jika garam dapur mudah rapuh. Ujilah kerapuhan garam dapur yang
masih berbentuk balok.
4. Contoh Ikatan Ion Lainnya :
a . Ikatan ion pada 19K dan 8O dalam K2O [1]
Konfigurasi elektron:
K : 2, 8, 8, 1 (melepas 1 elektron) membentuk K+
O : 2, 6 (menerima 2 elektron) membentuk O2–
2K+ + O2– → K2O
b. Ikatan ion pada Fe (elektron valensi 3) dengan Cl (elektron valensi 7) membentuk FeCl3 [1]
Fe mempunyai elektron valensi 3 akan membentuk Fe3+
Cl mempunyai elektron valensi 7 akan membentuk Cl–
Fe3+ + 3Cl– → FeCl3
c. Ikatan ion antara Ca dan F [2]
Konfigurasi elektron:
Ca : 2, 7 (melepas 2 elektron) membentuk Ca2+ (2, 8)
F : 2, 7 (menerima 1 elektron) membentuk F + 1e- (2, 8) (Catatan : Supaya persamaan reaksinya setimbang maka F ada 2 sehingga menjadi 2F, masing-masing menerima 1 elektron dari Ca)
Sehingga persamaan reaksinya menjadi :
Ca2+ + 2F– → CaF2
4. Contoh Ikatan Ion Lainnya :
a . Ikatan ion pada 19K dan 8O dalam K2O [1]
Konfigurasi elektron:
K : 2, 8, 8, 1 (melepas 1 elektron) membentuk K+
O : 2, 6 (menerima 2 elektron) membentuk O2–
2K+ + O2– → K2O
b. Ikatan ion pada Fe (elektron valensi 3) dengan Cl (elektron valensi 7) membentuk FeCl3 [1]
Fe mempunyai elektron valensi 3 akan membentuk Fe3+
Cl mempunyai elektron valensi 7 akan membentuk Cl–
Fe3+ + 3Cl– → FeCl3
c. Ikatan ion antara Ca dan F [2]
Konfigurasi elektron:
Ca : 2, 7 (melepas 2 elektron) membentuk Ca2+ (2, 8)
F : 2, 7 (menerima 1 elektron) membentuk F + 1e- (2, 8) (Catatan : Supaya persamaan reaksinya setimbang maka F ada 2 sehingga menjadi 2F, masing-masing menerima 1 elektron dari Ca)
Sehingga persamaan reaksinya menjadi :
Ca2+ + 2F– → CaF2
 |
| Perpindahan elektron dari Ca ke F. |
Konfigurasi elektron:
Li : 2, 1 (melepas 1 elektron) membentuk Li+ (2)
O : 2, 6 (menerima 2 elektron) membentuk O + 2e- (2, 8)
Sehingga persamaan reaksinya menjadi :
2Li+ + O2– → Li2O
 |
| Perpindahan elektron dari Li ke O. |
Konfigurasi elektron:
Al : 2, 8, 3 (melepas 3 elektron) membentuk Al3+ (2, 8)
F : 2, 7 (menerima 1 elektron) membentuk F + 1e- (2, 8) (Catatan : Supaya persamaan reaksinya setimbang maka F ada 3 sehingga menjadi 3F, masing-masing menerima 1 elektron dari Al)
Sehingga persamaan reaksinya menjadi :
Al3+ + 3F– → AlF3
 |
| Perpindahan elektron dari Al ke F. |
Linus Carl Pauling (1901–1994)
 |
| Linus Carl Pauling. [3] |
Linus Carl Pauling (1901– 1994) adalah kimiawan terkenal abad ke-20. Dia
juga merupakan satu-satunya penerima dua hadiah Nobel untuk dua
kategori yang berbeda, yaitu Nobel Kimia pada 1954 dan Nobel Perdamaian
pada 1962. Sejak kecil Pauling sudah gemar membaca berbagai buku.
Pauling juga mengunjungi laboratorium kimia milik Lloyd Jeffress. Pada
saat SMA dia melanjutkan bereksperimen di bidang kimia menggunakan bahan
dan perlengkapan yang dia pinjam dari pabrik baja di tempat dia
bekerja. Karyanya di bidang kimia yang sangat dikagumi adalah hasil
penelitiannya tentang sifat-sifat ikatan kimia yang tertuang dalam
bukunya yang terkenal The Nature of the Chemical Bond and the Structure
of Molecules and Crystals: An Introduction to Modern Structural
Chemistry. (Sumber: Chem-is-try.org)
Ikatan kovalen
BENTUK MOLEKUL
Meskipun jumlah molekul sangat
banyak, tetapi jumlah cara atom menata dirinya membentuk molekul terbatas. Oleh sebab itu pengertian dan melukiskan bentuk molekul tidak begitu rumit
seperti yang dibayangkan.
Kebanyakan molekul mempunyai bentuk yang didasarkan kepada lima bentuk geometri yang berbeda.
Tujuan kita pada Seksi ini adalah agar saudara terbiasa membayangkan struktur molekul dalam
tiga dimensi. Saudara harus mempelajari bagaimana bentuk molekul ditentukan oleh bermacam-macam sudut yang
dibentuk oleh ikatan dan meskipun
saudara pada permulaan menemui kesulitan, saudara harus berL4aha menggambar bentuk struktur tersebut. (Untuk struktur-struktur yang
rumit, beberapa petunjuk diberikan). Berlatihlah, sampai saudara mampu
menggambar bentuk struktur, sehingga gambar tersebut dapat memberi informasi
tiga dimensi kepada saudara. Jika saudara mengerjakannya, maka saudara dapat
lebih mullah dan lebih menarik untuk mempelajari
struktur molekul. Marilah kita perhatikan sekarang lima struktur dasar,
dimulai dari yang paling sederhana.
Penataan atom dalam bentuk linier, bila semua atom berada
dalam bentuk garis lurus. Sudut yang
terbentuk di antara dua atom yang terikat yang menuju ke atom pusat, disebut sudut ikatan yang besarnya 180°
Empat
atom yang disusun membentuk segitiga (triangular) pads bidang rata, keempat
atomnya terletak pads bidang yang sama. Atom sentral dikelilingi oleh tiga atom yang membentuk
segitiga. Semua sudut ikatan besarnya 120°
Tetrahedron adalah piramid empat sisi yang mempunyai
tiga sudut yang sama.
Pada molekul tetrahedron, atom sentral terletak ditengah tetrahedron dan keempat atomnya terletak pada sudut-sudut.
Semua sudut ikatan sama besarnya yaitu 109,5°
Bipiramida
trigonal terdiri dari dua piramid trigonal (piramid dengan dasar triangular,
yang sama dengan tetrahedron) yang pennukaannya dibagi bersama.Molekul
bipiramid trigonal mempunyai atom pusat yang dikelilingi oleh lima atom lainnya. Atom pusat terletak di
tengah bidang triangular, dimana bidang ini merupakan bagian dari piramid atas
dan piramid bawah. Kelima atom yang melekat pada atom pusat terletak pada lima sudut. Pada molekul ini, tidak semua sudut ikatan sama. Di antara dua
ikatan yang terletak di bidang segitiga pusat, besar sudut ikatan adalah 120°.
Besar sudutnya hanya 90° antara ikatan dengan bidang segitiga pusat dengan
ikatan yang membentuk bipiramid trigonal di atas dan di bawah bidang
segitiga pusat. Apabila kita menggambar molekul bipiramid yang
trigonal, biasanya dibw gambar
segitiga dan kemudian melihat segitiga tersebut dari kedua sisi, dari atas dan bawah. Kemudian kita tank garis lurus
ke atas dan kebawah bipiramid trigonal
Suatu oktahedron adalah gambar
geometri yang mempunyai delapan permukaan. Kita dapat
membayangkan molekul tersebut terdiri dari dua piramid yang dasarnya
bidang empat persegi yang dipakai bersama. Perhatikan
bahwa gambar ini mempunyai enam sudut meskipun ada delapan permukaan. Pada molekul
oktahedron, atom pusat dikelilingi oleh enam atom lainnya. Atom pusat terletak
di tengah segi empat yang melalui titik tengah oktahedron. Keenam atom terikat ke atas
pusat dengan enam sudut oktahedron. Sudut
setup pasangan atom yang berdekatan besarnya sama
yaitu 90°
Untuk memudahkan menggambar oktahedron, biasanya
-digambar bidang segiempat, dari titik
tengah segiempat digambar garis lures ke atas dan ke bawah oktahedron.
Ikatan kovalen merupakan ikatan kimia yang terbentuk
dari pemakaian elektron bersama oleh atom-atom pembentuk ikatan. Ikatan kovalen
biasanya terbentuk dari unsur-unsur non logam. Dalam ikatan kovalen, setiap
elektron dalam pasangan tertarik ke dalam nukleus kedua atom. Tarik menarik
elektron inilah yang menyebabkan kedua atom terikat bersama.
Ikatan
kovalen terjadi ketika masing-masing atom dalam ikatan tidak mampu memenuhi
aturan oktet, dengan pemakaian elektron bersama dalam ikatan kovalen,
masing-masing atom memenuhi jumlah oktetnya. Hal ini mendapat pengecualian
untuk atom H yang menyesuaikan diri dengan konfigurasi atom dari yang tidak
terlibat dalam ikatan kovalen disebut elektron bebas. Elektron bebas ini
berpengaruh dalam menentukan bentuk dan geometri molekul.
Ada beberapa jenis ikatan kovalen yang semuanya
bergantung pada jumlah pasangan elektron yang terlibat dalam ikatan kovalen.
Ikatan tunggal merupakan ikatan kovalen yang terbentuk 1 pasangan elektron.
Ikatan rangkap 2 merupakan ikatan kovalen yang terbentuk dari dua pasangan
elektron, beitu juga dengan ikatan rangkap 3 yang terdiri dari 3 pasangan elektron.
Ikatan rangkap memiliki panjang ikatan yang lebih pendek daripada ikatan
tunggal. Selain itu terdapat juga bermacam-macam jenis ikatan kovalen lain
seperti ikatan sigma, pi, delta, dan lain-lain.
Jadi pada teori ini, kestabilan ikatan kovalen dapat
dijelaskan dengan terjadinya tumpang tindih “overlapping”
orbital-orbital atom. Dengan konsep hibridiasi pun dapat jelaskan bentuk
molekul yang diramalkan dalam teori VSEPR, namun disayangkan untuk kasus-kasus tertentu,
semisal pada senyawa CO2, pada teori ini senyawa tersebut akan
bersifat diamagnetic tetapi pada kenyataannya berdasarkan hasil percobaan, CO2merupakan
senyawa para magnetic akibat 2 pasang electron yang tidak berpasangan (lonepair
electron).
Senyawa
kovalen dapat dibagi mejadi senyawa kovalen polar dan non polar. Pada senyawa
kovalen polar, atom-atom pembentuknya mempunyai gaya tarik yang tidak sama
terhadap elektron pasangan persekutuannya. Hal ini terjadi karena beda
keelektronegatifan antara atom-atom penyusunnya. Akibatnya terjadi pemisahan
kutub positif dan negatif. Sementara itu pada senyawa kovalen non-polar titik
muatan negatif elekton persekutuan berhimpit karena beda keelektronegatifan
yang kecil atau tidak ada.
v
Ikatan kovalen koordinasi
Ikatan kovalen koordinat merupakan ikatan kimia yang
terjadi apabila pasangan elektron bersama yang dipakai oleh kedua atom disumbangkan
oleh sala satu atom saja. Sementara itu atom yang lain hanya berfungsi sebagai
penerima elektron berpasangan saja.
Syarat-syarat terbentuknya ikatan kovalen koordinat :
- Salah
satu atom memiliki pasangan elektron bebas
- Atom
yang lainnya memiliki orbital kosong
Kenyataan bahwa keempat ikatan kovalen N-H
mempunyai panjang ikatan yang sama menyarankan bahwa penggambaran khusus ikatan
kovalen koordinasi tidak bermanfaat kecuali hanya mengindikasikan proses
pembentukan pasangan elektron sekutu saja dan oleh karena itu muatan ion menjadi milik seluruh gugus amonium.
Susunan
ikatan kovalen koordinat sepintas mirip dengan ikatan ion, namun kedua ikatan
ini berbeda oleh karena beda keelektronegatifan yang kecil pada ikatan kovalen
koordinat sehingga menghasilkan ikatan yang cenderung mirip kovalen.
v
Ikatan Logam
Lebih
dari delapan puluh unsur yang ada di sistem
periodik unsur adalah logam. Logam bersifat padat pada
temperatur dan tekanan standar, dengan pengecualian unsur merkuri dan galium
yang keduanya berupa cairan. Sebagai pengingat, sifat-sifat logam adalah
sebagai berikut:
Ikatan
logam adalah suatu kekuatan utama yang menyatukan atom-atom logam. Ikatan logam
merupakan akibat dari adanya tarik menarik muatan positif dari logam dan muatan
negatif dari elektron yang bergerak bebas .
Untuk menjelaskan ikatan pada logam, Lorentz
mengusulkan sebuah model yang dikenal dengan model gas elektron atau model
lautan elektron. Model ini didasarkan pada sifat logam berikut:
Logam
umumnya mempunyai energi
ionisasi yang rendah. Secara tak langsung, pengertian
ini merujuk pada elektron valensi yang tidak terikat dengan kuat oleh inti.
Elektron valensi dapat bergerak dengan bebas diluar pengaruh inti. Dengan
demikian, logam mempunyai elektron yang bebas bergerak.
Telah
diteliti bahwa logam mempunyai banyak orbital yang kosong sebagai akibat
elektron valensi logam lebih rendah daripada orbital valensi logam. Sebagai
contoh, logam litium mempunyai orbital 2pyang kosong; natrium mempunyai
orbital 3p dan 5d yang kosong; dan magnesium mempunyai orbital 3p dan 3d yang juga masih kosong.
Elektron yang paling luar pada sebagian besar logam biasanya mempunyai
hubungan yang tidak erat dengan ini karena letaknya yang jauh dari muatan
positif inti. Semua elektron valensi logam-logam bergabung membentuk lautan
elektron yang bergerak bebas di antara inti atom. Elektron yang bergerak bebas
beraksi sebagai ikatan terhadap ion bermuatan positif. Ikatan logam tidak
mempunyai arah. Akibatnya, ikatan tidak rusak ketika logam ditempa.
Contoh ikatan unsur yang mempunyai ikatan logam adalah sebagian besar logam
seperti Cu, Al, Au, Ag, dsb. Logam
transisi seperti Fe, Ni, dsb membentuk ikatan campuran
yang terdiri dari ikatan kovalen (pada elektron 3d) dan ikatan logam.
2. Ikatan
Antara Molekul
v
Ikatan Hidrogen
Ikatan hidrogen adalah
sebuah interaksi tarik-menarik (dipol-dipol) antara atom yang bersifat elektronegatif dengan atom hidrogen yang
terikat pada atom lain yang juga bersifat elektronegatif. Jadi, ikatan hidrogen
tidak hanya terjadi pada satu molekul, melainkan bisa antara molekul satu
dengan molekul yang lainnya. Ikatan hidrogen selalu melibatkan atom hidrogen.
Ikatan hidrogen bersifat
lebih kuat dibandingkan gaya van der Waals, tetapi lebih lemah dibandingkan ikatan kovalen maupun ikatan
ion
.
Ikatan hidrogen sangat
dominan dalam kimia air, larutan air, pelarut hidroksilik, spesies yang
mengandung gugus -OH umumnya, dan penting juga dalam sistem biologi misalnya
sebagai penghubung rantai polipetida dalam rantai protein dan pasangan basa
dari asam nukleat.
v
Ikatan van der walls
Gaya Van Der Walls dahulu dipakai untuk menunjukan
semua jenis gaya tarik menarik antar molekul. Namun kini merujuk pada gaya-gaya
yang timbul dari polarisasi molekul menjadi dipol seketika. Ikatan ini
merupakan jenis ikatan antar molekul yang terlemah, namun sering dijumpai
diantara semua zat kimia terutama gas. Pada saat tertentu, molekul-molekul
dapat berada dalam fase dipol seketika ketika salah satu muatan negatif berada
di sisi tertentu. Dalam keadaa dipol ini, molekul dapat menarik atau menolak
elektron lain dan menyebabkan atom lain menjadi dipol. Gaya tarik menarik yang
muncul sesaat ini merupakan gaya Van der Walls.




Tidak ada komentar:
Posting Komentar